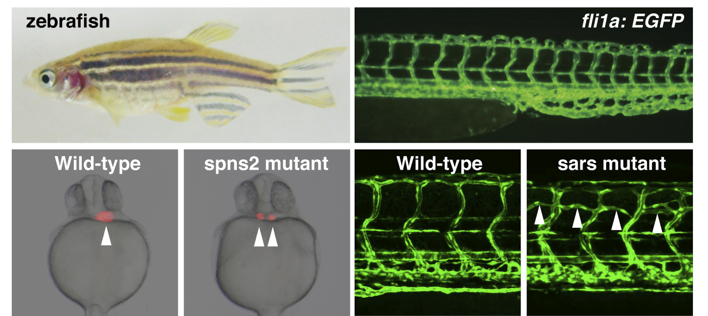
循環器系は、形態形成の初期から機能する極めて重要な生命システムですが、その分子メカニズムは十分には理解されていません。我々は、哺乳類と循環器系の形成過程が非常に良く保存されているゼブラフィッシュを用いて、循環器系を司る分子の実体の解明を目指しています。我々は、順遺伝学的な解析手法を用い循環器系に特異的な異常を示すゼブラフィッシュ変異体を作製しました。ゲノムマッピング解析により循環器系を制御しうる新規分子を同定しています。特に、心臓前駆細胞の異常により2つの心臓の表現型(二叉心臓)を示す変異体の原因遺伝子は、新規の膜タンパク質Spns2分子でした。この分子が脂質メディエーターであるスフィンゴシン-1-リン酸(S1P)の輸送体として機能することを世界に先駆け発見しました。脂質メディエーターの分泌機構はこれまでブラックボックスでしたので、Spns2の発見は脂質生物学の分野で大変注目されています。現在は、S1Pの生理機能の全貌解明を目指し、下記のゲノム編集技術を用いS1P受容体(S1PR1-S1PR5)の網羅的な遺伝子改変ゼブラフィッシュの作製とそれらの機能解析を進めています。
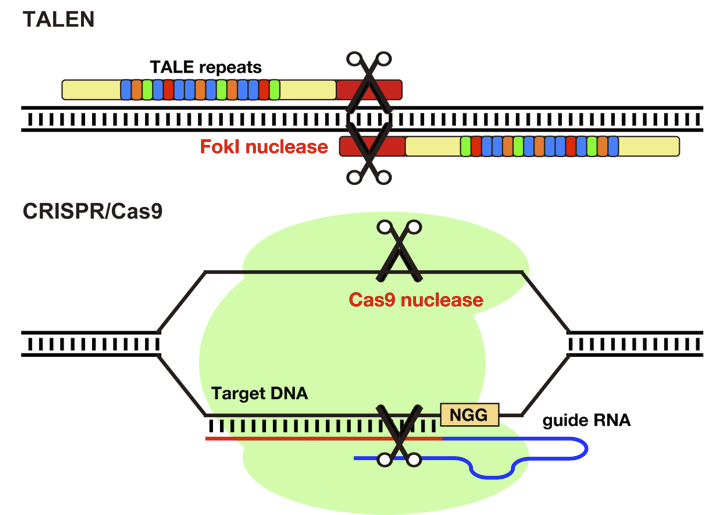
我々は、ゲノム編集技術(TALEN, CRISPR/Cas9)を用いた遺伝子改変ゼブラフィッシュの作製法の開発に成功しました。その過程で我々が考案したLacZα遺伝子破壊測定法とheteroduplex mobility assay (HMA)がゲノム編集活性の評価法として大変有用であることを報告しました。このゲノム編集技術を活用して循環器制御因子の生体内での機能をその遺伝子を破壊した時の表現型解析から明らかにしたいと考えています。我々は、現在、効率的な遺伝子置換法(ノックイン法)の開発に取り組んでいます。効率的なノックイン法が樹立できた場合、ヒト遺伝子疾患の原因遺伝子をゼブラフィッシュの相同遺伝子と置換することによってヒト遺伝病に相当する疾患モデル生物の作製が可能となります。疾患モデル・ゼブラフィッシュを器官形成の可視化系統と掛け合わせることにより、病態の進行過程を詳細に解析できると考えています。また、ゼブラフィッシュ胚は1〜2mmと非常に小さく化合物の効果を飼育水に加えることで簡単に評価できるなどケミカル•スクリーニングに最適です。そこで、疾患モデル・ゼブラフィッシュの病態を抑える低分子化合物の探索とその作用機序を調べることで新たな治療薬の開発へつなげていきたいと考えています。