
Transforming growth factor-β (TGF-β: 腫瘍増殖因子ベータ)は生体内に存在する生理活性タンパク分子(サイトカイン)であり、細胞の増殖、アポトーシス、分化、遊走、細胞外マトリックス産生の制御作用など多彩な機能をもつ(Massague J. The transforming growth factor-β family. Annu. Rev. Cell Biol 1990)。TGF-βはそれらの機能を介して、発生や免疫、創傷治癒などの生命現象に深く関与しているとともに、癌や線維化、動脈硬化、神経疾患、リウマチ/アレルギーといった様々な疾患の病態形成にも関わっている(Lodish HF et al. Role of transforming growth factor-β in human disease. N Engl J Med 2000.)。
TGF-βシグナル:作用メカニズムと疾患における意義ー研究の背景から将来への展望までー
(文責 中尾篤人 平成18年6月1日)
図1 TGF-βの多彩な作用
Transforming growth factor-β (TGF-β: 腫瘍増殖因子ベータ)は生体内に存在する生理活性タンパク分子(サイトカイン)であり、細胞の増殖、アポトーシス、分化、遊走、細胞外マトリックス産生の制御作用など多彩な機能をもつ(Massague J. The transforming growth factor-β family. Annu. Rev. Cell Biol 1990)。TGF-βはそれらの機能を介して、発生や免疫、創傷治癒などの生命現象に深く関与しているとともに、癌や線維化、動脈硬化、神経疾患、リウマチ/アレルギーといった様々な疾患の病態形成にも関わっている(Lodish HF et al. Role of transforming growth factor-β in human disease. N Engl J Med 2000.)。
種々の細胞に対して、あまりに多彩な作用をTGF-βがもつため、このようなバラエティーに富んだTGF-β作用がいったいどのようにして惹起されるのかということは、この分野の研究者の素朴かつ最大の関心事であった。異なる細胞種で異なるTGF-β作用が認められるというだけでなく、同じ細胞でも分化段階や活性化状態の違いによってTGF-βに対する反応性が異なることが数多く報告されている。
このような複雑なTGF-β作用を理解するには、TGF-βが細胞表面の受容体に結合したあと細胞内でどのようなシグナル伝達経路が活性化されるのかをまず突き止める必要があった。またこのようなTGF-β作用のシグナル伝達経路が明らかにされたとき、その経路がTGF-βが関係する様々な疾患においてどのような役割を果たしているのかを明らかにすることは疾患病態を理解する上で大変重要である。さらに、このようなTGF-β作用のシグナル伝達経路の基礎的な理解をもとに、難治性疾患に対する新しいコンセプトの治療法を見いだすためのプラットフォームを発信することは基礎医学の最終目標である。
山梨大学医学部免疫学講座
〒409-3898
山梨県中央市下河東1110
TEL:055-273-9542
Copyright© 2023 Dept Immunology, Univ Yamanashi. All right reserved.

“各個人が強いモチベーションで楽しみながら行うのが研究である”という考えのもと学生が能動的、主体的に研究に取り組むことが最も大切であると思っています。
また、上下関係ではなくコミュニケーションをベースとした指導を常に心がけています。
したがって、学生には
(1)とにかくやる気があって自発的に(教官の指示など待たずに)行動すること
(2)研究室の教官や大学院生、他の研究室の人達と積極的にコミュニケーションをとること、
の2点を強く要求します。それ以外のこと(知識や実験の経験など)は、まったく問いません。
花粉症や喘息に悩む人、ぜひ一緒に研究しましょう。(平成23年3月 中尾篤人)
我々の研究室では、主にアレルギー疾患(喘息、花粉症、食物アレルギーなど)の病態生理を、様々な視点からより深いレベルで解明し、アレルギー疾患の新しい予防法や治療薬を開発するためのカギとなる基礎的知見を発見することを目標としています。
現在の主なテーマは以下の通りです。
(1)アレルギー疾患と体内時計との関係(Nakamura et al. J Allergy Clin Immunool in press 2011).
(2)母乳中のTGF-βのアレルギー疾患予防メカニズムの解明(Nakao A. Clin Exp Allergy 2010, Ando et
al. J Allergy Clin Immunol 2007, Okamoto et al. Int Immunol 2005)
(3)喫煙による喘息発症機構の解明(Nakamura et al. J Allergy Clin Immunol 2008)
(4)食物アレルギーに対するポリフェノールの効用 (Manuscript in preparation)
(5)炎症性腸疾患と芳香族炭化水素受容体との関係(Takamura et al. Immunol Cell Biol 2010, 2011 in
press).
*なお研究テーマについては学生の意向を強く尊重しています。
我々の研究室では、主にアレルギー疾患(喘息、花粉症、食物アレルギーなど)の病態生理を様々な視点からより深いレベルで解明し、アレルギー疾患の新しい予防や治療法を開発するためのカギとなる基礎的な知見を発見することを目標としています。
現在は、主にアレルギー(免疫)と体の中で時間を刻む仕組み(体内時計)との関係について精力的に研究しています(Nakamura et al. J Allergy Clin Immunol 2011)。この研究のゴールは細胞の時間を制御することによるアレルギーの新しい治療法を見つけることです。
このような試みは世界の他のアレルギーの研究室ではほとんど行われていないオリジナリティーの高いものです。
花粉症や喘息、食物アレルギーなどに悩む人や興味がある人は僕らの常識を変えるような新しいアレルギー研究にぜひ参加してください。
中尾篤人(平成25年5月1日)

TGF-β/Smadシグナルの阻害による難治性疾患の治療というコンセプトは、我々が1999年に肺線維症をモデルとして初めて実験的に示した(Nakao A. et al. J Clin Invest 1999)。このコンセプトの延長として、現在スミスクラインなどの大手製薬会社がTGF-β受容体阻害剤を開発し(Yingling JM et al. 2004.Development of TGF-β signalling inhibitors for cancer therapy. Nat. Rev. Drug Discov. 3:1011)これを用いて実際に線維症や癌などに有効であるか否かを検討する臨床試験が欧米で進んでいる。
最近、我々は関節リウマチにおいても、このようなアプローチが有効であるというデータを得ており、このようなアプローチは将来より多くのTGF-β関連疾患に有用となるかもしれない。今後も我々は、このようなTGF-βシグナルの阻害(あるいは増強)が疾患病態の改善に有効な病気を探していき、より効率的かつ根本的な難治性疾患の治療に結びつけていきたい。
また我々は、前述のように、経口的なTGF-βの投与がアレルギー反応を選択的に抑制できることを示した。この研究を進めることによって、現在我が国を含め先進国において顕著に増加しているアレルギー疾患(花粉症、喘息、食物アレルギーなど)の予防や治療が非常に簡便な方法(TGF-βを飲ませるだけ!)によって可能となるかもしれない。この研究に伴う特許を取得し(現在は申請中)、乳児の飲む人工ミルクへのTGF-βの添加や成人へはサプリメントのような形で、TGF-β経口投与のアイデアを実用化し、『アレルギー疾患の根絶』といった夢の実現を目指していきたい。
上記のようにSmadシグナル伝達経路の発見はTGF-β研究の分野におけるブレークスルー的知見であり世界的に評価されている。例えば、今年、世界で初めて出版されるSmadシグナル伝達経路に関する総説本の中の抑制型Smadの章の著者として選定された(Smad
signaling pathway, edited by Drs. Heldin CH and ten Dijke P, Chapter9,
Inhibitory Smads: mechanisms of action and roles in human disease, Springer,
in press)。またTGF-βシグナル経路の中でネガティブフィードバック的に働く抑制分子Smad7の同定は、ほぼ同じ時期にほかのシグナル伝達経路においても(例えばJAK/STAT経路抑制分子であるSOCSなど)そのような抑制分子が存在することが同定され、それらの発見ともあわさって、細胞にとって普遍的に備わっている負のシグナル調節のメカニズムとして、分子細胞生物学的に認知されている。実際、分子生物学の有名な教科書の1つである「ゲノムgenomes」(TA
Brown著、 BIOS Scientific Publishers, Ltd. 初版((日本版))page 308)にはSmad7によるTGF-βシグナルのネガティブフィードバック調節が、我々の文献付きで紹介されている。
上記の主たる研究成果を報告した主要5論文がどれだけ研究のインパクトを他の研究者に与えたかを客観的に評価するために5論文の被引用度数を以下に示す(本年5月28日現在、Web
of Science調べ)。
1.J Biol Chem 1997 (times cited: 91).
2.EMBO J 1997 (times cited: 417).
3.Nature 1997 (times cited: 617).
4.J Exp Med 2000 (times cited: 67).
5.J Clin Invest1999 (times cited: 155).
これら(あるいは我々の他の)の論文の被引用回数は、公表年に比して非常に多く、この分野の研究の進歩に強く貢献していると考えられる。
Smadシグナル伝達経路の同定によってTGF-βの多彩な作用をもたらす分子基盤がその後次々と明らかにされてきた。これらの進歩を踏まえ、現在この分野の国内外の研究者は、TGF-β/Smadシグナルの生理的あるいは病理学的な意義について個体レベルで明らかにしようという方向に向かっている。我々は既にこのような研究の方向性を指向し、Smadシグナル伝達経路の様々な疾患における役割を個体レベルで明らかにしてきており、世界的にも評価を受けている(下記欄も参照のこと)。
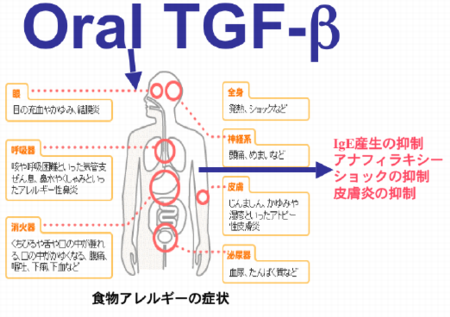
さらに最近、我々は母乳中に含まれるTGF-βの生物学的意義に着目し以下の研究を行った。
これまでの疫学的研究から、母乳中に多量に含まれるサイトカインの1つであるTGF-βがアトピー性皮膚炎や喘息などの乳幼児のアレルギー性疾患や感染症の発症を抑制する可能性が指摘されている。(J
Allergy Clin Immunol 1999;1251, J Allergy Clin Immunol 2003;723 etc.)。しかしながらこれまでTGF-βが経口的に投与されたときに免疫系に及ぼす影響について直接的に解析した研究はほとんどなく、したがって、どのような機序によって経口的に摂取されたTGF-βがアレルギー疾患等の発症に影響を与えるのか、あるいはもっと根本的な疑問として、本当に免疫系に経口TGF-βは作用を及ぼすことができるのか等について、まったくわかっていなかった。
我々はこの問題に注目し、TGF-βの経口的な投与が、実際に全身の免疫応答に影響を与えるか否かについて、マウス食物アレルギーモデルにおいて検討した。その結果、経口的な高用量のTGF-β投与は、アレルゲン特異的なIgE抗体産生などの体液性免疫応答(Th2反応)を抑制し、細胞性免疫応答(Th1反応)は逆に増強することが明らかになった(Okamoto
A, Kawamura T, Kanbe K, Kanamaru Y, Ogawa H, Okumura K, Nakao A: Suppression
of serum IgE response and systemic anaphylaxis in a food allergy model
by orally administered high-dose TGF-β. Int Immunol 2005)。
この知見は、将来、乳幼児の人工ミルクや成人の摂る飲食物にTGF-βを含有させることによって、アレルギー性疾患を予防できる可能性を示唆した。このような夢の実現のため、以下のような特許を日本、アメリカ、オーストラリアにおいて申請中である(アレルギー予防方法又は治療方法、飲食品、並びに経口医薬品特願2005-252912)。
現在、なぜ経口的なTGF-βの投与がアレルギー反応を選択的に抑制できるのかについての詳細なメカニズムについて解析すると同時に、この手法の実用化に向けて食品会社や製薬会社との共同研究の提携に努力しているところである。
最近、我々はTGF-β受容体の阻害剤によって関節リウマチも抑制できることを見出しており(Sakuma M, Nakao A et al. TGF-β type I receptor kinase inhibitor downregulates rheumatoid synoviocytes and prevents arthritis induced by type II collagen antibody. submitted)TGF-β/Smadシグナルの阻害が今後、より多くの難治性疾患の治療に有用となる可能性が期待される。
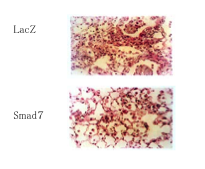
図5 Smad7の肺における過剰発現によるブレオマイシン誘発肺線維症の抑制
アデノウイルスベクターによって肺局所にSmad7を発現することによってブレオマイシン誘導性の肺の線維性変化を抑制することができた(写真上;コントロールベクターをいれた肺 写真下;Smad7を発現した肺)。肺の線維性変化が写真下では抑制されている。
肺や肝臓等に見られる線維化疾患(肺線維症や肝硬変など)は、未だ線維化を抑える有効な治療法がない難治性疾患である。肺線維症の病態にはTGF-βが関わっていることが報告されており、その過剰発現あるいは活性化によってコラーゲンなどの細胞外マトリックスの産生が増強され線維化が起きると考えられている。我々は肺線維症のモデルであるブレオマイシン誘発性肺線維症マウスモデルを用いて肺におけるSmad7の人為的な発現によって肺線維化が抑制できることを示した(Nakao
A, et al. Transient gene transfer and expression of Smad7 prevents bleomycin-induced
lung fibrosis in mice. J Clin Invest1999)。
この知見はSmadシグナルの阻害剤が線維性疾患の予防/治療に有用である可能性を世界で初めて示唆したものである。したがってこの論文の被引用件数もきわめて高い(この論文の被引用回数は155回。本年5月28日現在)。
また我々は、マウス疾患モデルではなく、ヒトの疾患において実際にTGF-β/Smad経路が疾患病態に関与しているのかについて検討するために喘息患者における重症度や気道炎症、気道リモデリングといった喘息病態とSmad経路の活性化(リン酸化Smad2分子の発現)との相関関係について検討した。その結果、Smad経路の活性化が喘息の重症度や気道リモデリング病態に関与していることを示すことができた。(Sagara
H, Nakao A et al.: Activation of TGF-β/Smad2 signaling is associated with
airway remodeling in asthma. J Allergy Clin Immunol 2002
Nakao A et al.: Expression of Smad7 in bronchial epithelial cells is inversely correlated to basement membrane thickness and airway hyperresponsiveness in patients with asthma. J Allergy Clin Immunol 2002.)
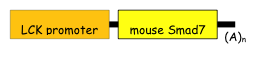
図4 T細胞選択的にSmad7を発現するトランスジェニックマウスの作成に用いたコンストラクト。
T細胞選択的に発現するタンパク質であるlck タンパク遺伝子のpromoterを用いることによってT細胞選択的にSmad7を発現するトランスジェニックマウスを得ることができる。
免疫応答においてTGF-βは重要な調節的役割を持つと考えられていたが、すべての細胞はTGF-βに反応しうるため、免疫系のどの細胞に対するTGF-βの調節作用が生体内で重要なのかについてはわかていなかった。そこで、我々はT細胞にのみSmad7を発現するトランスジェニックマウスを作成した(Nakao A, et al. Blockade of TGF-β/Smad signaling by overexpression of Smad7 in T cells enhances antigen-induced airway inflammation and airway reactivity. J Exp Med 2000)。このマウスではSmad7のTGF-βシグナル抑制作用によりT細胞においてのみTGF-β作用が阻害される。したがってT細胞における内因性のTGF-β作用の役割について生体内で解析することができる。
本マウスの解析から、T細胞に対する内因性のTGF-β作用の阻害の有無にかかわらず、免疫系の恒常性は維持されている(マウスに特殊な表現型は起らなかった)ことがわかった。また喘息誘発時における気道の炎症反応がこのトランスジェニックマウスでは増強していた。すなわち、T細胞に対する内因性のTGF-β/Smadシグナルは免疫系の恒常性維持には必須ではなく、炎症反応が起る際に、炎症を抑制するシグナルとして働いていることが示唆された。
本論文は免疫系におけるTGF-βの役割についてT細胞特異的にピンポイントに示すという免疫学的な意義があるだけでなく、シグナル伝達系の負の制御分子を細胞選択的に発現させたトランスジェニックマウスを作成しそれによって細胞特異的に生体内におけるシグナル経路の役割を明らかにしていくという新規のアイデアを提起した。実際、この手法はその後多くの論文において使用されている。(この論文の被引用回数は67回である。本年5月28日現在、Web of Science調べ)。
図3 TGF-βシグナル伝達経路(基本モデル)
(Nakao A. Trend Immunology 22:115, 2001, Review)
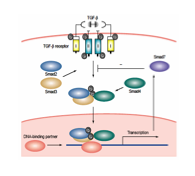
我々は、分子生物学的手法によりTGF-β作用を細胞内で伝達する分子として、Smad2分子を発見した(Nakao A. et al. Identification of Smad2, a human Mad-related protein in the TGF-β signaling pathway. J Biol Chem 1997) 。またSmad2, Smad3, Smad4が協調して(タンパク質複合体を形成して)TGF-β作用を細胞内で伝達し、TGF-β標的遺伝子群の転写を活性化する仕組みを解明した(Nakao A. et al. TGF-β receptor mediated signaling through Smad2, Smad3, and Smad4.EMBO J 1997)。さらに予想外のこととして、TGF-β作用を細胞内で伝達するSmad2/Smad3/Smad4経路を抑制するSmad分子であるSmad7を同定した(Nakao A. et al. Identification of Smad7, a TGF-β-inducible antagonist of TGF-β signaling. Nature 1997)。興味深いことにSmad7は、TGF-βによって誘導されTGF-βシグナルを抑制するネガティブフィードバック的に働く分子であった。以上の報告は、TGF-β作用を惹起する細胞内でのしくみ(細胞内シグナル伝達経路)に関する基本的モデル(Smad分子が受容体によってリン酸化されること、複合体を作ること、それらが細胞核へ移行すること、この複合体によって標的遺伝子の転写が開始されること、抑制型Smadが存在すること)(図3参照)を構築する概念をすべて見出したブレークスルー的報告であり、その後、これらの論文は数多くの後続論文に引用されている。(JBC paper; times cited: 91, EMBO paper; times cited: 417, Nature paper; times cited: 617, 本年5月28日現在、Web of Science調べ)
またこのSmadファミリー分子群の同定によってその後、当初の重要な疑問であるTGF-βの持つ多彩な作用の分子機序についての理解が急速に進んでいる(Massague J. How cells read TGF-β signals. Nature Rev Mol Cell Biol 2000)。
図2 研究目的に対する背景
TGF-β作用を伝達するシグナル伝達経路は1990年代の後半まで明らかにされておらずその同定が待望されていた。シグナル伝達経路が明らかでなかったため、TGF-βが多彩な細胞への作用を持つことができる理由や、TGF-β関連疾患の病態の理解、それらの疾患を制御する方法についてほとんど進歩がなかった。
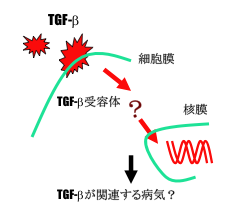
以上のような研究の背景から、我々の研究の目標は以下の3点に集約される。