感染制御部 病院教授・井上 修 (Osamu Inoue)
 内科専門医。2003年11月より附属病院検査部、2010年4月より現臨床検査医学講座に所属。元は呼吸器内科医であった私井上も研究の世界に魅せられ、コラーゲン、ラミニン等の細胞外物質による血小板活性化メカニズムの解明をテーマに、血栓止血分野の研究者として活動中。最近はCLEC-2に興味の対象が移り、"beyond clotting" の世界にはまりつつある。血小板と癌、血小板とアレルギー疾患など、血小板研究と呼吸器疾患治療との融合も模索中。
内科専門医。2003年11月より附属病院検査部、2010年4月より現臨床検査医学講座に所属。元は呼吸器内科医であった私井上も研究の世界に魅せられ、コラーゲン、ラミニン等の細胞外物質による血小板活性化メカニズムの解明をテーマに、血栓止血分野の研究者として活動中。最近はCLEC-2に興味の対象が移り、"beyond clotting" の世界にはまりつつある。血小板と癌、血小板とアレルギー疾患など、血小板研究と呼吸器疾患治療との融合も模索中。
2児の父。近距離・街乗りのお手軽サイクリング派。小径折りたたみ自転車など小さく精緻なメカが好み。地の利を活かしてダウンヒル(バイク)にも進出したいが、怪我とコストが怖くて踏み出せずにいる。第2子が生まれてからこれまで、研究と(臨床と)日々の生活に追われる毎日で愛車は静態保存の状態へ。
2013年4月より附属病院安全管理部准教授に着任。
所属 : 山梨大学医学部附属病院安全管理部
学歴 : 1996年3月 山梨医科大学医学部(卒業)
2003年9月 University of Oxford, D.Phil course(終了)
2005年3月 学位授与(同上)
学位 : 博士(医学) ( University of Oxford, U.K. )
資格 : 日本内科学会認定 総合内科専門医
ICD制度評議会認定 Infection Control Doctor
職歴 : 1996年5月 関東逓信病院内科レジデント
1998年5月 NTT東日本関東病院呼吸器科シニアレジデント
2003年11月 山梨大学医員(検査部)
2005年4月 山梨大学助手(検査部)
2007年4月 山梨大学助教(検査部)
2007年4月 山梨大学助教(検査部)
2010年4月 山梨大学助教(臨床検査医学)
2013年4月 山梨大学医学部付属病院准教授(安全管理部)
所属学会 : 日本内科学会
日本血栓止血学会・評議員
日本呼吸器学会
日本肺癌学会
International Society on Thrombosis and Haemostasis
American Society for Biochemistry and Molecular Biology
受賞 : <<研究活動に対する受賞>>
- 平成18年日本血栓止血学会学術奨励賞 ( 日本血栓止血学会 )
- 平成18年度戦略的プロジェクト若手研究者表彰 ( 山梨大学 )
- 平成18年山梨大学医学会若手研究者表彰奨学金 ( 山梨大学 )
- 優秀ポスター賞 ( 第31回日本血栓止血学会各術集会会長 ) ( 2008年 )
- 第32回日本血栓止血学会学術集会 第1回 2011 Memorial Award ( 日本血栓止血学会 ) ( 2009年 )
Integrin
Integrinは細胞表面に発現する接着受容体の仲間です。一対のalpha subunitとbeta subunitからなり、血小板にはコラーゲン受容体のalpha2 beta1, フィブロネクチン受容体のalpha5 beta1, ラミニン受容体のalpha6 beta1等beta1-integrin familyと、フィブリノーゲン受容体のalphaIIb beta3, ビトロネクチン受容体のalphav beta3等のbeta3-integrn familyが発現しています。2001年より開始した最初の研究テーマは「コラーゲン受容体 integrin alpha2 beta1は血小板活性化を惹起できるのか?」というものでした。
呼吸器内科医としての臨床経験しかなかった私ですが、一大決心をし、ポスドクとして英国Oxford大学Steve P. Watson研究室に留学する妻について一緒に渡英する事にしました。2001年4月の事です。幸い妻の実験助手(見習い)として研究室への出入りが許されたため、この機会を最大限有効に活用して研究のノウハウを学ぶ事にしました。
2001年12月・クリスマスランチ
御存知のように、血小板は生体内での生理的な血栓止血の中心を担う血液細胞です。血管壁が傷害されると、壁の構造蛋白であるコラーゲンが露出します。血小板はこの露出したコラーゲンに接着する事で活性化され、凝集塊を形成し、生理的な止血を担う or 病的血栓形成を引き起こします。このコラーゲン惹起血小板凝集には、血小板膜上のコラーゲン受容体glycoprotein VI(GPVI)が主役を演じていることがGPVI/Fc receptor gamma欠損マウスの解析結果より解明されていましたが、もう一つのコラーゲン受容体integrin alpha2beta1 (GPIa/IIa)の役割は当時よくわかっておらす、役立っていないのではないか?といった見方が優勢でした。
妻は留学前にbeta1-integrin(GPIa/IIaを含む)を活性化する特異抗体TS2/16を用いてGPIa/IIaが血小板内のシグナル分子を活性化する事をBloodに報告にしていましたが、抗体刺激という非生理的な条件での非生理的な現象なのではないかとの疑念がぬぐえず、生理的なアゴニストでも再現できるか非常に興味を持っていました。この問題に決着を付ける事が自分の最初のテーマになりました。
研究手法は改良に改良を重ね、いよいよ実験開始です。
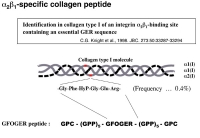 血小板膜上にはGPVI/Fc receptor gamma complexとintegrin alpha2beta1の2種類のコラーゲン受容体が存在します。また、コラーゲン上にはこれらのコラーゲン受容体に結合する結合motifが複数存在します。従って、integrin alpha2beta1のシグナルだけを調べたい場合に、コラーゲンを用いた検討は出来ません。
血小板膜上にはGPVI/Fc receptor gamma complexとintegrin alpha2beta1の2種類のコラーゲン受容体が存在します。また、コラーゲン上にはこれらのコラーゲン受容体に結合する結合motifが複数存在します。従って、integrin alpha2beta1のシグナルだけを調べたい場合に、コラーゲンを用いた検討は出来ません。
そこで、英国ケンブリッジ大学のKnightらが同定したintegrin alpha2beta1結合motifを含む合成ペプチドを利用して実験を行いました。このmotifは Gly-Phe-HyP-Gly-Glu-Arg (単表記:GFOGER) という配列から成っており、タイプ I コラーゲンでは1分子に2個存在します。これをGPC(GPP)5GFOGER(GPP)5GPCという配列のペプチドとして合成します。GPCやGPPは血小板活性化能のない配列です。これを入手し、固相化して実験に用いました。
Laminin
糖蛋白lamininは内皮細胞が接着する基底膜の主要な構成成分です。 血管内皮細胞が接着する血管内皮基底膜にもlamininが豊富に存在しています。血管内皮細胞が傷害を受け脱落した場合、何か起こるでしょうか?基底膜が露出し、血流に暴露されるのではないでしょうか。2003年からはこのlamininによる血小板活性化の可能性についての研究を開始しています。
ラミニンは生体材料からの抽出・精製が複雑であり研究用試薬としてはマウスEngelbreth-Horm-Swarm腫瘍というラミニンを含む細胞外物質を分泌する腫瘍細胞由来のラミニンがしばしば利用されています。このマウス腫瘍由来ラミニンを用いた検討からは、”血小板はラミニンに接着するが、ラミニンにより血小板は活性化されない”と報告され(Journal of Cell Biology 1984)、以後ラミニンは血小板非活性化物質として認知されてきました。しかしこのマウスラミニンには腫瘍由来の異常な糖鎖が認められ、細胞接着活性や活性化能が弱いことが近年報告されています。
そこでヒト胎盤から精製したヒト由来のラミニンを用いて、ラミニンが血小板を活性化するかどうか、再検討する事にしました。
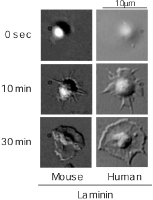 Figure 1興味深い事に、固相化したヒトラミニン上では、血小板は時間とともに血小板伸展(spreading)する事が分かりました(Figure 1)。血小板spreadingは固相化したコラーゲンやGFOGERペプチドに接着した血小板がintegrin alpha2beta1からのoutside-in signalで活性化され、惹起された形態変化と同じ現象です。このことから、ラミニンによって integrinを介した活性化シグナルが惹起された可能性が強く示唆されました。そこで、次に血小板膜上のラミニン受容体として報告されているintegrin alpha6beta1の阻害抗体を用いて、再度観察してみました。
Figure 1興味深い事に、固相化したヒトラミニン上では、血小板は時間とともに血小板伸展(spreading)する事が分かりました(Figure 1)。血小板spreadingは固相化したコラーゲンやGFOGERペプチドに接着した血小板がintegrin alpha2beta1からのoutside-in signalで活性化され、惹起された形態変化と同じ現象です。このことから、ラミニンによって integrinを介した活性化シグナルが惹起された可能性が強く示唆されました。そこで、次に血小板膜上のラミニン受容体として報告されているintegrin alpha6beta1の阻害抗体を用いて、再度観察してみました。
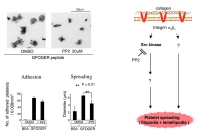
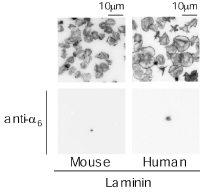 Figure 2すると、当たり前の結果なのですが、ラミニンへの血小板接着を担う受容体を阻害したため、ラミニンへの血小板接着は強く抑制されました。非特異的に結合したと思われる血小板にはspreadingは観られませんでした (Figure 2)。このことから、コラーゲン受容体であるintegrin alpha2beta1がコラーゲンへの接着依存性に血小板を活性化し、spreadingを引き起こす現象と同じなのではないかと(当初は)考えました。
Figure 2すると、当たり前の結果なのですが、ラミニンへの血小板接着を担う受容体を阻害したため、ラミニンへの血小板接着は強く抑制されました。非特異的に結合したと思われる血小板にはspreadingは観られませんでした (Figure 2)。このことから、コラーゲン受容体であるintegrin alpha2beta1がコラーゲンへの接着依存性に血小板を活性化し、spreadingを引き起こす現象と同じなのではないかと(当初は)考えました。
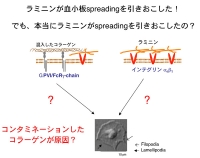 しかし、工業製品である今回使用したラミニンは、ヒト胎盤からの
しかし、工業製品である今回使用したラミニンは、ヒト胎盤からの
精製品であり、強力なコラーゲンが混入している可能性は否定できません。そこでコラーゲン受容体glycoprotein VI (GPVI) の欠損したマウス血小板を用い、ラミニン上での血小板の振る舞いを観察してみました。
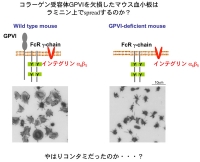 Figure 3 Figure 3 左側に示すように、正常マウス血小板はラミニン上でspreadingしました。ところが、スライド右側のごとく、GPVI欠損マウス血小板はラミニンに接着はするもののlamellipodiaの形成は強く抑制されました。この期待に反する結果からは、ラミニンにコラーゲンが混入していて、血小板はラミニンではなく混入しているコラーゲンの刺激で活性化した可能性が強く示唆されます。この結果には非常にがっかりでした。しかしそれでは研究がストップしてしまいます。そこで、この現象を説明できる可能性がある仮説を立ててみる事にしました。
Figure 3 Figure 3 左側に示すように、正常マウス血小板はラミニン上でspreadingしました。ところが、スライド右側のごとく、GPVI欠損マウス血小板はラミニンに接着はするもののlamellipodiaの形成は強く抑制されました。この期待に反する結果からは、ラミニンにコラーゲンが混入していて、血小板はラミニンではなく混入しているコラーゲンの刺激で活性化した可能性が強く示唆されます。この結果には非常にがっかりでした。しかしそれでは研究がストップしてしまいます。そこで、この現象を説明できる可能性がある仮説を立ててみる事にしました。
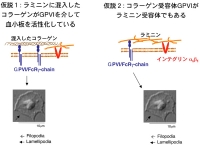 コラーゲン受容体GPVIがラミニン受容体でもあり、GPVIとラミニンの結合が血小板を活性化しているのではないか、という仮説です。この仮説を検証するには、ラミニンに混入しているかもしれないコラーゲンを取り除く必要があります。コラーゲン定量化の代表的な方法であるhydroxyproline assayで混入コラーゲンを定量化する事も試みましたが、直接取り除く処理が必要であり、コラゲナーゼで消化してしまう事にしました。
コラーゲン受容体GPVIがラミニン受容体でもあり、GPVIとラミニンの結合が血小板を活性化しているのではないか、という仮説です。この仮説を検証するには、ラミニンに混入しているかもしれないコラーゲンを取り除く必要があります。コラーゲン定量化の代表的な方法であるhydroxyproline assayで混入コラーゲンを定量化する事も試みましたが、直接取り除く処理が必要であり、コラゲナーゼで消化してしまう事にしました。
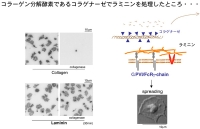 Figure 4Figure 4に示すように、固相化したコラーゲンをコラゲナーゼで処理するとコラーゲンは消化され断片化し、血小板は接着できなくなります。一方、ラミニンをコラゲナーゼ処理しても、血小板は相変わらず接着し、spreadingする事が分かりました。という事は、ラミニンがGPVIを介して血小板を活性化していた、という事になります。この発見は、本研究をさらに前進させるGOサインとなりました。
Figure 4Figure 4に示すように、固相化したコラーゲンをコラゲナーゼで処理するとコラーゲンは消化され断片化し、血小板は接着できなくなります。一方、ラミニンをコラゲナーゼ処理しても、血小板は相変わらず接着し、spreadingする事が分かりました。という事は、ラミニンがGPVIを介して血小板を活性化していた、という事になります。この発見は、本研究をさらに前進させるGOサインとなりました。
 Figure 5GPVI/FcR gamma-chain欠損マウス血小板は、figure 3に示したようにラミニンへ接着はするもののlamellipodia形成は強く抑制されていました。ラミニンへの接着はintegrin alpha6beta1を介し、ラミニンによる血小板活性化はGPVI/FcR gamma-chainを介するため、という事で説明が出来ました。では、ヒト血小板もやはりGPVI/FcR gamma-chainを介して活性化されるのでしょうか?GPVI/FcR gamma-chain 欠損ヒト血小板は入手が困難なため、培養細胞に造らせたGPVI-Fc2(ヒト免疫グロブリンIgGのFc部分と、IgG Fab部分にヒトGPVI細胞外ドメインを持つリコンビナント蛋白・詳細は Miura et al., 2002 JBC参照)をヒト血小板浮遊液に過剰に添加し、ラミニン上のGPVI結合部位を飽和してしまう事で、ヒト血小板がラミニンにGPVIを介して結合するのを阻害してみる事にしました。
Figure 5GPVI/FcR gamma-chain欠損マウス血小板は、figure 3に示したようにラミニンへ接着はするもののlamellipodia形成は強く抑制されていました。ラミニンへの接着はintegrin alpha6beta1を介し、ラミニンによる血小板活性化はGPVI/FcR gamma-chainを介するため、という事で説明が出来ました。では、ヒト血小板もやはりGPVI/FcR gamma-chainを介して活性化されるのでしょうか?GPVI/FcR gamma-chain 欠損ヒト血小板は入手が困難なため、培養細胞に造らせたGPVI-Fc2(ヒト免疫グロブリンIgGのFc部分と、IgG Fab部分にヒトGPVI細胞外ドメインを持つリコンビナント蛋白・詳細は Miura et al., 2002 JBC参照)をヒト血小板浮遊液に過剰に添加し、ラミニン上のGPVI結合部位を飽和してしまう事で、ヒト血小板がラミニンにGPVIを介して結合するのを阻害してみる事にしました。
結果はFIgure 5に示すように、GPVI-Fc2添加血小板は、GPVI/FcR gamma-chain欠損マウス血小板と同様にラミニンに対して接着はするものの、lamellipodia形成が著明に抑制される事が判明しました。ヒト血小板はマウス血小板と同様に、ラミニンへintegrin alpha6beta1を介して接着し、GPVI/FcR gamma-chainを介して活性化されるという事が判明しました。
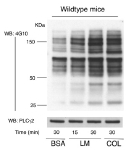 FIgure 6A ラミニンに接着し、活性化される血小板ですが、細胞内で伝達される活性化シグナルはどの様になっているのでしょうか?血小板活性化メカニズムでは、シグナル分子の蛋白質チロシンリン酸化反応が重要な役割を演じています。Figure 6Aは固相化したラミニンとコラーゲン上に接着して活性化された血小板を溶解し、蛋白濃度を合わせた後電気泳動し、抗リン酸化チロシン抗体でウエスタンブロットしたものです。ラミニン上で血小板が活性化され、シグナル分子のリン酸化チロシンが経時的に増加する様子が分かります。また、30分後のラミニン上での蛋白質チロシンリン酸化パターンはコラーゲン上でのパターンと酷似しています。血小板はラミニン上でコラーゲン受容体GPVIを介して活性化されるという今までの実験結果と一致する実験結果といえます。
FIgure 6A ラミニンに接着し、活性化される血小板ですが、細胞内で伝達される活性化シグナルはどの様になっているのでしょうか?血小板活性化メカニズムでは、シグナル分子の蛋白質チロシンリン酸化反応が重要な役割を演じています。Figure 6Aは固相化したラミニンとコラーゲン上に接着して活性化された血小板を溶解し、蛋白濃度を合わせた後電気泳動し、抗リン酸化チロシン抗体でウエスタンブロットしたものです。ラミニン上で血小板が活性化され、シグナル分子のリン酸化チロシンが経時的に増加する様子が分かります。また、30分後のラミニン上での蛋白質チロシンリン酸化パターンはコラーゲン上でのパターンと酷似しています。血小板はラミニン上でコラーゲン受容体GPVIを介して活性化されるという今までの実験結果と一致する実験結果といえます。
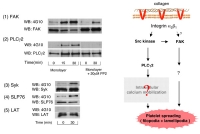
 Figure 6B GPVI下流で役割を演じているシグナル分子は、各国の研究者により大まかに解明されています。そこで、それらのシグナル分子が、確かにラミニン刺激でも活性化されているか確かめるため、figure6Bに挙げる各シグナル分子について、ワイルドタイプマウスとGPVI欠損マウスから採取した血小板を用いてチロシンリン酸化が増加するかどうか実験してみました。
Figure 6B GPVI下流で役割を演じているシグナル分子は、各国の研究者により大まかに解明されています。そこで、それらのシグナル分子が、確かにラミニン刺激でも活性化されているか確かめるため、figure6Bに挙げる各シグナル分子について、ワイルドタイプマウスとGPVI欠損マウスから採取した血小板を用いてチロシンリン酸化が増加するかどうか実験してみました。
結果は、予想通りSyk, LAT, SLP-76, Btk, PLCgamma2などGPVIによる血小板活性化での主要なシグナル分子は、ラミニンによりチロシンリン酸化が増加しました。一方で、GPVI欠損マウス血小板では、FcRgamma, SLP-76, LAT, Btkのチロシンリン酸化増加が抑制されてました。面白い事に、SykとPLCgamma2については、GPVI欠損にもかかわらずラミニン刺激により若干のチロシンリン酸化増加が認められました。これはおそらく、もう一つのラミニン受容体であるintegrin alpha6beta1を介した血小板活性化シグナルの影響ではないかと思われます。おなじインテグリン受容体であるコラーゲン受容体integrin alpha2beta1はやはりSykとPLCgamma2を活性化し、血小板spreadingを惹起する事が出来ます。ラミニン受容体のalpha6beta1も同じbeta1-integrin familyであり、おそらくalpha2beta1と類似したシグナルメカニズムが有るのではないかと予想しています。ちなみに、beta1-integrinの細胞内ドメインにはSykが結合できる、という報告もあります。
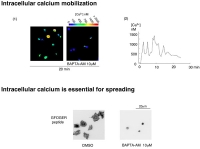
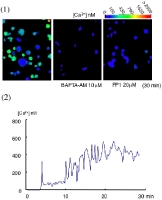 FIgure 7 最後に、ラミニンに接着することで、PLCgamma2の重要な役割である細胞内カルシウム動員がたしかに惹起されるか、血小板内のカルシウム濃度の測定をしてみました。御存知のように、PLCは細胞膜内のPIP2をIP3とDGに分解し、IP3は細胞内小胞体のIP3-sensitive Ca-channelに作用しカルシウム放出を促します。これを測定するためには、細胞内カルシウム濃度測定試薬のFURA-2 AMを血小板に取り込ませ、蛍光顕微鏡下に励起光(340/380nm)をあて、それぞれの励起光によって励起された蛍光の強度が細胞内カルシウム濃度によって変化する事から、蛍光強度の340/380比を算出し、細胞内カルシウム濃度を測定します。今回の実験では、スライド写真の上の色のグラデーションバーがカルシウム濃度を示します。
FIgure 7 最後に、ラミニンに接着することで、PLCgamma2の重要な役割である細胞内カルシウム動員がたしかに惹起されるか、血小板内のカルシウム濃度の測定をしてみました。御存知のように、PLCは細胞膜内のPIP2をIP3とDGに分解し、IP3は細胞内小胞体のIP3-sensitive Ca-channelに作用しカルシウム放出を促します。これを測定するためには、細胞内カルシウム濃度測定試薬のFURA-2 AMを血小板に取り込ませ、蛍光顕微鏡下に励起光(340/380nm)をあて、それぞれの励起光によって励起された蛍光の強度が細胞内カルシウム濃度によって変化する事から、蛍光強度の340/380比を算出し、細胞内カルシウム濃度を測定します。今回の実験では、スライド写真の上の色のグラデーションバーがカルシウム濃度を示します。
ラミニンに接着した血小板は青色から緑色となり、赤色まではいきませんが確かに細胞内のカルシウム濃度が上昇している事が分かります。血小板一つに絞って観察してみると、スライド下のグラフのように約30分以上にわたりオッシレーションを繰り返しながら細胞内のカルシウムが動員され続ける事が分かります。
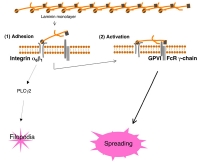 Model これまでの実験結果から導かれる、血管壁細胞外物質ラミニンへの血小板接着・活性化モデルです。
Model これまでの実験結果から導かれる、血管壁細胞外物質ラミニンへの血小板接着・活性化モデルです。
血小板はラミニンにintegrin alpha6beta1を介して接着します。コラーゲン受容体glycoprotein VI(GPVI)はラミニン受容体でもあり、GPVIを介して惹起される血小板活性化シグナルにより血小板は血管壁傷害部位局所で活性化され、血小板進展(spreading)します。GPVIと血小板が結合するためには、integrin alpha6beta1 を介して血小板とラミニンが強固に結合する必要があります。
 Blood. 2006;104(4):1248-9 この報告はBlood誌上で別途ご紹介頂きました。
Blood. 2006;104(4):1248-9 この報告はBlood誌上で別途ご紹介頂きました。

ここまで研究にご協力下さいました諸先生方に感謝申し上げます。
Laminin・続編
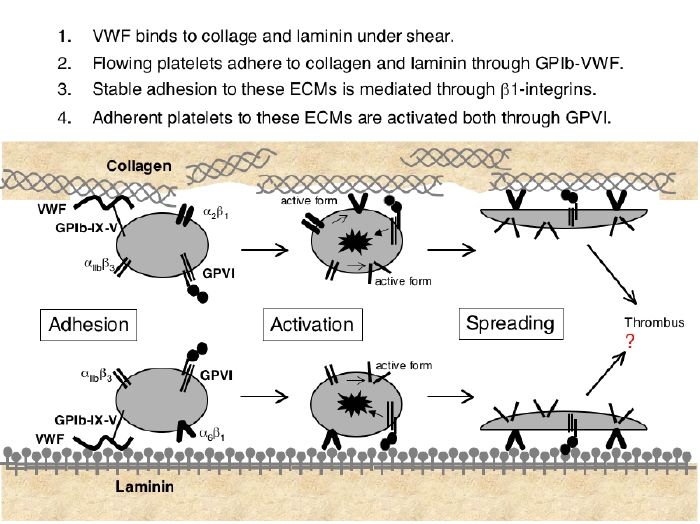
血流に逆らって血小板がラミニンに結合する事がわかりました。そのメカニズムも判明したので、掻い摘んでご紹介します。
以下作製中。

 ホーム
ホーム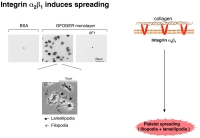
 前のページへ
前のページへ